Materiales plásticos en contacto con productos farmacéuticos

El material plástico es uno de los más utilizados para contener medicamentos y/o productos farmacéuticos (botes de pastillas, aerosoles, envases para soluciones orales y oftalmológicas, etc.). Estos envases deben ser fabricados con materias primas y aditivos específicos, y deben cumplir con una serie de requisitos legislativos vigentes según el país en el que se vaya a comercializar.
¿Qué materiales se usan para los envases farmacéuticos y medicamentos?
Los materiales plásticos más utilizados en la fabricación de envases farmacéuticos son poliolefinas, como el polietileno de alta o baja densidad (HDPE o LDPE) y el polipropileno (PP), el policloruro de vinilo (PVC) y el polietileno tereftalato (PET).
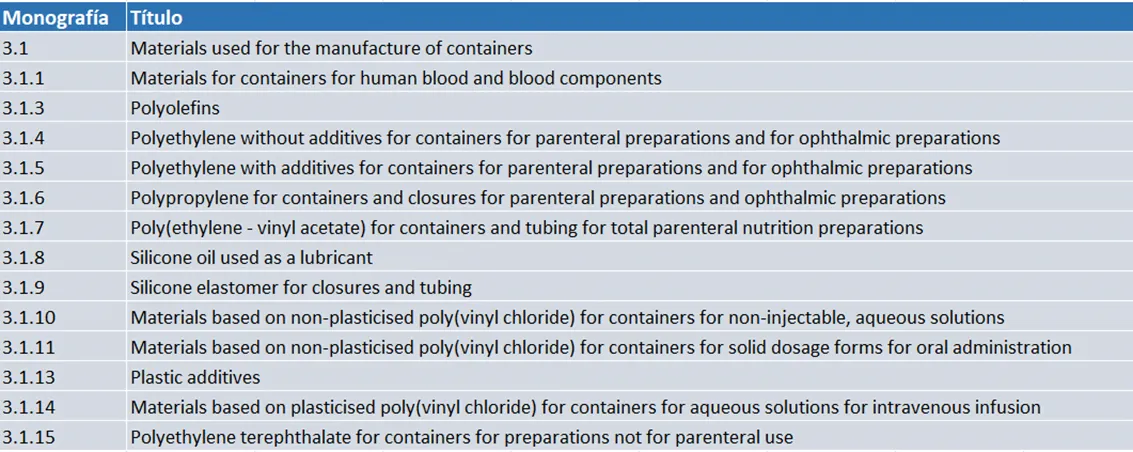
Los materiales y aditivos que pueden ser empleados están mencionados en las distintas monografías que recoge la Legislación Europea. Para cada uno de ellos, se indica qué tipo de ensayos en concreto se debe realizar. A continuación, se muestra un resumen de las monografías:
¿Cuáles son los tipos de envases farmacéuticos que existen?
- Blisters
- Bolsas de un solo uso
- Bombas dosificadoras
- Botellas
- Botes
- Cajas
- Envases pelables
- Film
- Film estirable
- Film retráctil
- Flow-pack
- Preformas
- Sleeves
- Tapas y tapones
- Tubos
¿Qué legislación debe aplicarse a un envase farmacéutico?
La Farmacopea es la legislación que aplica a los productos con propiedades medicinales. Las diferentes Farmacopeas que existen están sometidas a sucesivas modificaciones centradas sobre todo en los medicamentos o excipientes y menos en los requisitos de los envases que los contienen. En relación con el envasado, cada Farmacopea contiene unas monografías concretas que establecen los procedimientos y los criterios de aceptación que debe cumplir el material para garantizar la seguridad del consumidor.
Si nos centramos en la Farmacopea Europea (Ph. Eur.), ésta contiene el capítulo 3.1 donde se describen los materiales y aditivos en concreto que pueden usarse para la fabricación de envases farmacéuticos y el capítulo 3.2 que trata sobre los envases finales.
Los aditivos indicados en el capítulo 3.1 incluyen antioxidantes, estabilizadores, plastificantes, lubricantes, colorantes y modificadores de impacto. Para cada polímero establecido en dicho capítulo se enumeran los aditivos que son aceptables, según se trate de poliolefinas, polietileno, polipropileno, etc. Como se indica en el capítulo 3.2, pueden utilizarse otros aditivos siempre que sean aprobados en cada caso por la autoridad competente responsable de conceder la autorización de comercialización del producto farmacéutico.
Debemos tener en cuenta que el proveedor del envase farmacéutico es quién informa sobre el cumplimiento con la legislación correspondiente al envasador que produce el medicamento. Sin embargo, la responsabilidad de que dicho envase cumpla con los requisitos recae sobre la empresa envasadora que pide la autorización para la comercialización del producto farmacéutico.
Protocolos para el control de la calidad de los envases de plástico en la industria farmacéutica
Según la Ph. Eur. los ensayos pertinentes se realizan sobre las muestras tipo, y los resultados obtenidos se dan por válidos siempre y cuando se cumpla las siguientes medidas:
- El fabricante garantice que los envases producidos a granel son similares en todos los aspectos a las muestras tipo;
- No haya cambios en la composición del material definido para las muestras tipo;
- No haya ningún cambio en el proceso de fabricación definido para las muestras tipo, especialmente en lo que respecta a las temperaturas a las que se expone el material plástico durante la fabricación;
- No se utiliza material de desecho.
Cabe mencionar que hasta el momento ha habido 10 ediciones de la Farmacopea Europea (Ph. Eur.), y 11ª edición se ha publicado el 1 de julio de 2022. Los textos nuevos y revisados de esta edición entrarán en vigor el 1 de enero de 2023 (salvo indicación contraria), por lo que, debemos estar atentos a los cambios y novedades que se deba implementar.
¿Cuáles son las indicaciones para cumplir con los requisitos de autorización?
Existe la “Guía de envases primarios de plástico” de la EMEA (European Medicines Agency Inspections) que aborda la información sobre los materiales plásticos que se utilizan como envase primario de sustancias activas y medicamentos que debe presentarse en solicitudes de autorización de comercialización.
Esta guía es aplicable únicamente a envases plásticos primarios, es decir, materiales de envasado destinados a estar en contacto directo con el principio activo o el medicamento. Los materiales pueden formar parte del envase, del cierre, o de otras partes del sistema de cierre del envase. Los elastómeros y el caucho natural y sintético no entran en el ámbito de aplicación de esta directriz.
La información que debe presentarse, en cada caso, es: Información general; Especificaciones; Estudios de extracción; Estudios de interacción y/o Documentación toxicológica. Para conocer qué documentos deben facilitarse, la Guía muestra en los Apéndices I y II un árbol de decisiones según el medicamento a envasar. Los requisitos dependen forma de la dosis (solución, suspensión, polvo, tabletas…) del fármaco, indicado en el Apéndice I, y de la ruta de administración (inhalación, transdérmico, oral…) y recogido en el Apéndice II.
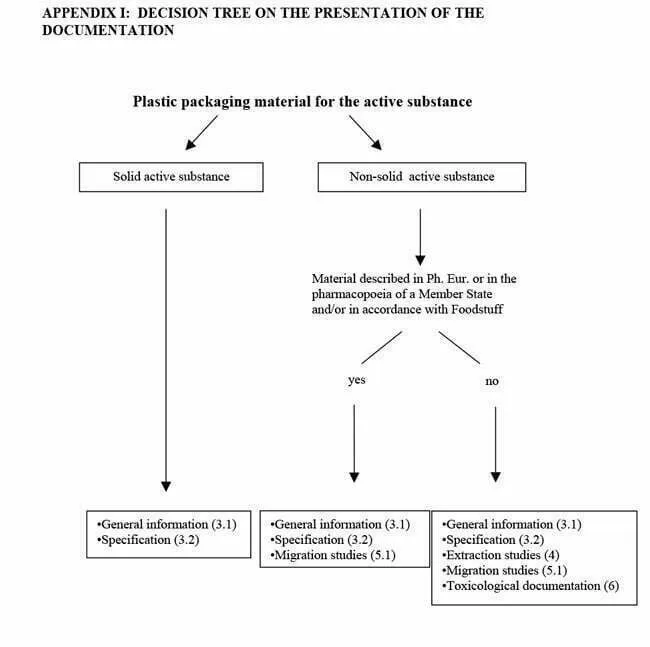
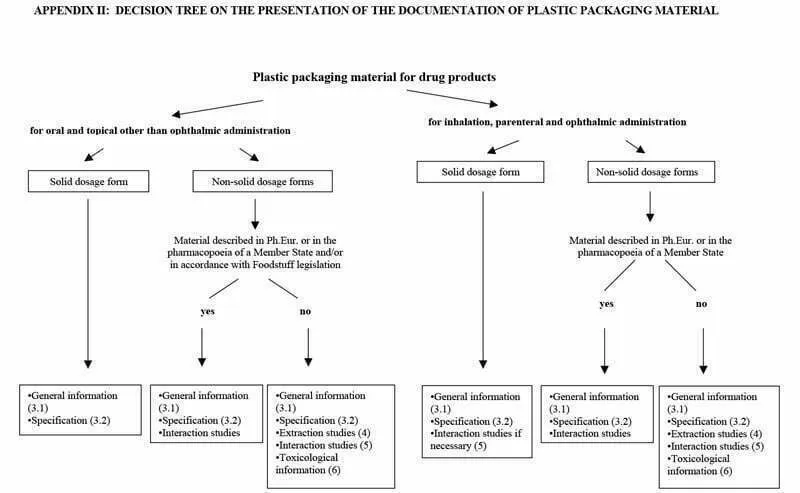
Fuente: Guideline on plastic immediate packaging materials. EMEA
En nuestros laboratorios podemos asesorarte y realizar los ensayos correspondientes para el cumplimiento con la Legislación. Contacta e infórmate.